Покриващ пласт, благоприятсващ ефективността на генните терапии
Международно проучване, публикувано в Science Translational Medicine предлага подход за намаляване на риска от предизвикване на имунен отговор от страна на генни терапии с адено-свързани вируси. Изследователите са успели да скрият вирусния геном от имунната система, предотвратявайки активиране срещу терапията, което може да компрометира ефективността на лечението и здравето на пациентите.
Генната терапия, която се състои от използване на генетични инструкции като лечение, представлява много обещаваща терапевтична възможност за множество генетични заболявания. Едно от многото нейни предизвикателства е да се разработят вектори, които да транспортират тези инструкции до клетките или прицелната тъкан, които са най-адекватни за лечение на болестта.
Адено-асоциираните вируси са придобили голям интерес като вектори за генни терапии, тъй като те не са патогенни за пациентите и могат да се насочат към различни тъкани. Отговорът на имунната система обаче към наличието на обвивка на вируса или на неговото съдържание представлява важно ограничение за потенциалното му систематично използване в клиничната практика. Геномният материал на вируса например активира протеина TLR9, разположен в мембраната на определени имунни клетки. TLR9 специфично открива чужда за човешките кетки ДНК и активира имунен отговор, който завършва с идентифициране на асоциирания аденовирус и може да застраши безопасността на терапията и здравето на пациента.
Международно проучване, ръководено от Харвардския университет, се занимава с този проблем и представя стратегия, която позволява на генната терапия с аденоасоцирани вируси да избегне имунната система.
Екипът от изследователи е включил в генома на аденоасоциирани вируси набор от кратки некодиращи ДНК последователности, които скриват наследствения материал на вируса от действието на имунната система. "Ние предполагаме, че малките фрагменти на ДНК, които се свързват и инхибират активирането на TLR9, включително ДНК последователностите в краищата на хромозомите, наречени теломери, биха били начин за скриване на генома на аденоасоциирания вирус от този механизъм за имунен надзор", казва Ин Кай Чан, първи подписващ работата, гостуващ изследовател в Института Wyss на Харвардския университет и научен директор в Ally Therapeutics, стартираща компания, създадена да разработва и комерсиализира продукти, насочени към избягване на имунните бариери на генната терапия.
Изследователите са тествали в различни животински модели ефективността на молекулярната "мантия-невидимка", предоставена от олигонуклеотидите, инхибитори на TLR9, интегрирани във вирусния геном. Както при мишки, така и при прасета и в различни тъкани, те са забелязали, че аденоасоциираната вирусна терапия с инхибиторни олигонуклеотиди предизвиква по-нисък имунен отговор от този, наблюдаван при животните, лекувани с контролен аденоасоцииран вирус.
Сред анализираните тъкани се откроява анализът, който екипът от изследователи е извършил върху окото. Този орган се счита за особено привилегирован, когато се обмисля генна терапия, тъй като има кръвно-ретинална бариера, която регулира движението на молекулите към ретината и ограничава навлизането на имунни клетки и други имунологични фактори. Някои проучвания обаче установяват, че високите дози могат да причинят възпаление, което показва, че окото не е напълно чуждо на имунния отговор на генната терапия.
Изследвайки ефикасността на модифицираните аденоасоциирани вируси като генна терапия в окото, изследователите са получили значителни резултати за проектирането на бъдещи терапии. От една страна, при модел на свине те откриват, че субретиналното приложение на аденоасоциирана вирусна терапия, предназначена да избегне имунната система, е в състояние да избегне неблагоприятните ефекти, наблюдавани при използване на нормален аденоасоцииран вирус. Чрез използването на по-малко инвазивен метод за доставка обаче, като инжектиране в кухината на стъкловидното тяло в модел на макак, екипът установява, че интегрирането на къси последователности в генома на аденоасоциирани вируси не успява да предотврати възпалителна реакция. Лечението забавя нежеланата реакция, но не я предотвратява.
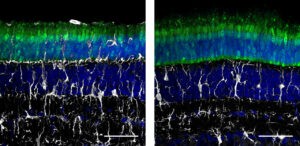
Въпреки че интравитреалният път е по-желателен поради по-малко инвазивния си характер и способността да достигне до по-голям брой клетки, той обикновено не се използва при генни терапии, тъй като генерира по-голям имунен отговор. Предвид неспособността на модифицираните аденоасоциирани вируси да предотвратят действието на имунната система при този метод на приложение, изследователите предполагат, че в допълнение към TLR9 може да участват и други имунни механизми. „Резултатите от свързаната с аденовирус интравитреална токсичност и умереният отговор на блокиращата последователност на TLR9 и стероидите показват, че има повече от един механизъм, влияещ върху токсичността в това място на инжектиране“, казва Констанс Чепко, професор по генетика и невронауки в Института Блаватник на Харвардския университет, изследовател от Медицинския институт на Хауърд Хюз и член на Института за стволови клетки в Харвард, участвал в изследването.
Резултатите от работата показват, че е възможно да се модулира имунния отговор срещу компонентите на генните терапии с адено-свързани вируси. Авторите са открили, че ефективността на стратегията зависи от използвания модел, което отваря нови пътища за изследвания за подобряване на един от най-обещаващите подходи за лечение на генетични заболявания. „Всяка нова терапевтична модалност, която постига първоначален успех в клиниката, трябва да се справя с възникващите проблеми, преди да бъде широко внедрена, и генната терапия с асоциирани аденовируси не е изключение“, изтъква Чан. "Нашата работа представлява критична точка в развитието на следващото поколение по-безопасни и по-ефективни вектори на аденоасоцииарани вируси."
Referencia: Chan YK, et al. Engineering adeno-associated viral vectors to evade innate immune and inflammatory responses. Sci Transl Med. 2021. DOI: http://dx.doi.org/10.1126/scitranslmed.abd3438
Fuente: A new vision for AAV-delivered gene therapies. https://wyss.harvard.edu/news/a-new-vision-for-aav-delivered-gene-therapies/
Автор: Amparo Tolosa, Genotipia
Превод от испански: Лиляна Петрова
Източник: Una capa de invisibilidad para favorecer la efectividad de las terapias génicas
Коментари
Публикуване на коментар