РНК ваксини за COVID-19
Последните съобщения от Pfizer / BioNTech и Moderna за резултатите от техните кандидат-ваксини за COVID-19 са обещаващи. И двете ваксини използват един и същ подход, за да подготвят тялото за евентуален контакт с коронавируса на SARS-CoV-2: използвайки синтетична информационна РНК с инструкции за вирусен протеин. Съществуват обаче разлики в състава му, както и в протокола за поддръжка и администриране. Независимо от това и в двата случая клиничните изпитвания все още продължават, така че резултатите не са окончателни, а наличната информация за ефикасността и безопасността на ваксината до момента идва от прессъобщенията, издадени от компаниите.
От междинна молекула до терапевтичен вариант
РНК ваксините следват стратегията за използване на РНК, молекула по-малко постоянна от ДНК, като терапевтично средство. Този подход се основава на факта, че въвеждането на синтетична информационна РНК в клетката я превръща в производител на въпросния протеин. По този начин, ако се приложи РНК, която кодира терапевтичен протеин за лечение на заболяване, самите клетки ще се превърнат в малки фабрики за производството на лекарството.
Въпреки простотата на своя подход, разработката на лекарства, базирани на РНК, се е сблъскала с няколко предизвикателства преди да достигне до фазата на клинична оценка. Едно от тях е, че синтетичната РНК може да бъде открита като чужд агент в клетките и да бъде разградена, активирайки имунни механизми, които да възпрепятстват нейната терапевтична цел да произвежда протеин и може да представлява риск за потенциалните пациенти. Решаването на този проблем дойде от ръката на Каталин Карико и Дрю Вайсман през 2005 година и беше решаващ фактор в полза на изследването на РНК като терапевтична молекула. Освен това насърчи създаването на компании като Moderna и BioNTech, насочени към разработване на лекарства на базата на информационна РНК. И двете компании имат няколко продукта във фазата на клинично изпитване, но все още не са получили одобрение за нито един.
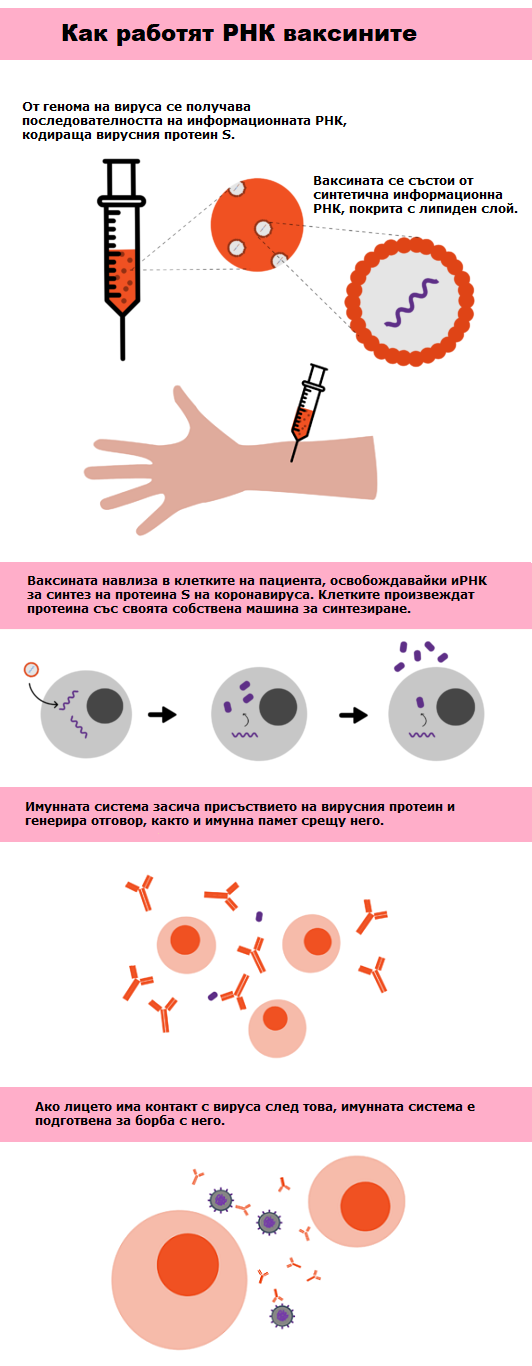
Как работят РНК ваксините
Подобно на останалите ваксини, целта на РНК ваксините е да предотврати инфекция, да обучи организма да може да разпознава инфекциозния агент и да действа срещу него в случай на контакт. РНК ваксините дават на клетките инструкции за производство на вирусен протеин, който предизвиква имунен отговор срещу специфичния инфекциозен агент и помага на организма да генерира имунна памет, която да го предпазва в бъдеще.
Предимство на този тип ваксина е, че нейният дизайн се основава на генома на инфекциозния агент, в този случай на коронавируса, и не е необходимо да се работи с него в лабораторията. Тази характеристика направи възможно в момента, в който е получен геномът на коронавирус на SARS-CoV-2, компании като Moderna или BioNtech да започнат да разработват своите кандидат-ваксини. В случая на Moderna, например, първата партида ваксина, тествана на клинично ниво, е завършена на 7 февруари, само месец след публикуването на генома на SARS-CoV-2. Първото инокулиране на тази ваксина на човек е на 16 март.
Ваксините, проектирани от Moderna и BioNTech
Ваксините, проектирани от Moderna и BioNTech, съдържат информационна РНК, която кодира вид протеин S на коронавируса. Този протеин има важна роля при навлизането на вируса в клетките, така че насочването на имунната система срещу него е обща стратегия на множество ваксини, не само на тези, базирани върху РНК.
Както mRNA-1273, ваксината на Moderna, така и BNT162b2, ваксината, проектирана от BioNTech, се състоят от липидна частица, която съдържа РНК, кодираща стабилизирана версия на протеин S. Тази РНК съдържа две промени в получената протеинова последователност, по този начин протеинът S запазва своята конформация от преди свързването с рецептора. Тази конформация най-добре отразява присъствието на истинския вирус, с който ще трябва да взаимодействат неутрализиращите антитела, генерирани от тялото. Кодиращата РНК на BNT162b2 има освен това някои от нейните нуклеозиди модифицирани, характеристика, която допринася за намаляване на разграждането на терапевтичната РНК, както е било наблюдавано в предишни проучвания.
Липидното покритие, използвано във ваксините благоприятства тяхното навлизане в клетките и след като РНК се освободи вътре, собствената машина на клетката се заема с производството на S протеина.
Двете ваксини на Moderna и на BioNTech изискват две дози, за да предизвикат защита. В случая на Moderna приемите са с интервал от 28 дни, докато при ваксината на BioNTech те са 21 дни.
За да отговори на нуждите от производство и разпространение на ваксината COVID-19, BioNTech си партнира с фармацевтичната компания Pfizer. Модерна провежда своите клинични изпитвания в сътрудничество с Националния институт по алергия и инфекциозни болести, част от Националния институт по здравеопазване на САЩ, и се финансира от Разширения орган за биомедицински изследвания и развитие, Министерство на здравеопазването и социалните услуги.
Как се тестват ваксините и какво се знае за тяхната ефективност
Както mRNA-1273, така и BNT162b2 са преминали през фаза 1 и фаза 2 на клиничните проучвания, които правят първоначална оценка на безопасността, поносимостта и потенциалната ефикасност на ваксините.
Понастоящем и двете ваксини се намират във фаза 3 на клиничните изпитания, които позволяват да се оцени ефикасността на лекарството или ваксината в по-голям мащаб. В тези проучвания хиляди участващи доброволци биват инокулирани с ваксината или плацебо като се очаква, че значителен брой от тях ще се заразят по естествен начин с вируса. Ако ваксината осигурява защита срещу вируса, очаква се броят на хората, които получават ваксината и се заразяват, да бъде значително по-малък от броя на хората, които получават плацебо и се заразяват. Ефикасността в условията на изпитване се изчислява от това колко участници, получили плацебо, са били заразени в сравнение с тези, които са получили ваксината, като всички те водят нормален живот, с прилагане на актуалните мерки за защита. Както при ваксината Pfizer / BioNTech, така и при Moderna, ефикасността е оценена от външни за двете проучвания комисии.
Общо в изследването на Pfizer и BioNTech участниците ще са 43 538, от които 38 955 са получили необходимите две дози до момента. Отговорниците за проучването обявиха, че ще извършат окончателен анализ, когато достигнат 164 заразени.
От друга страна, Moderna обяви тази седмица, че кандидат-ваксината е почти 95% ефективна, според първите резултати от проучване с над 30 000 души. В този случай ефикасността е изчислена върху 95 случая на инфекция, настъпила две седмици след втората доза ваксина, от които 90 съответстващи на плацебо групата и 5 на групата, получила ваксината.Прессъобщението на пресата, придружаващо съобщението на Moderna, се позовава също и на първите данни за защитата на нейната ваксина срещу най-сериозните случаи на COVID-19: от 11-те оценени тежки случая всички са получили плацебо. Moderna също така посочва, че повечето нежелани ефекти, свързани с ваксината, са умерени или леки и като цяло с кратка продължителност.
Досега информацията за ефикасността на двете ваксини във фаза 3 на изпитание произтича от съобщенията за пресата, представени от двете компании. Ще трябва да изчакаме да се извършат окончателните анализи, за да имаме по-подробна информация.
Актуално състояние на ваксините Pfizer / BioNTech и Moderna
Ваксината Pfizer / BioNTech BNT162b2 продължава оценявянето на изследванията във фаза 3 в САЩ, Германия, Аржентина, Бразилия, Южна Африка и други страни. Обявено е също и одобрение за започване на изпитания във фаза 2 в Китай, в сътрудничество с Fosun Pharma. В момента тази ваксина е получила наименованието „Fast Track” от Американската администрация по храните и лекарствата и е започнат процес на кандидатстване за Европейската агенция по лекарствата.
Алберт Бурла, президент и главен изпълнителен директор на Pfizer, посочи, че те ще изчакат да получат данните за безопасност на ваксината, съответстващи на медианата от два месеца след втората доза ваксина, за да поискат разрешение за спешна употреба от FDA . Според техните оценки това ще бъде около третата седмица на ноември. „Ефективността, безопасността и качеството на производство са трите изисквания, които са необходими, преди да можете да кандидатствате за разрешение“, казва Бурла на уебсайта на Pfizer.
Ваксината MRNA-1273 на Moderna се оценява във фаза 3 в САЩ. Прессъобщението на Moderna посочва, че в предвид на получените резултати, FDA ще поиска разрешение за спешна употреба през следващите седмици. Молби ще бъдат изпращани и до други регулаторни агенции, включително Европейската агенция по лекарствата.
Нерешени въпроси относно ваксините Pfizer / BioNTech и Moderna
Предварителните резултати и за двете ваксини са положителни и много обещаващи, особено ако се има предвид, че двете ваксини се тестват при хора от различни възрастови групи и различни общности. Все още има някои проблеми, които трябва да бъдат решени.
На първо място ще трябва да бъдат завършени текущите клинични изпитания, за да се получи възможно най-пълната информация за безопасността, ефикасността и ефектите на ваксините.
Например, един аспект е изследването на дългосрочния ефект на двете ваксини в организма, както на нивото на непрекъснато производство на протеин S, така и на нивото на защита срещу инфекция. Едно от предимствата за планиране на използването на терапевтична РНК, освен във ваксините, е, че тя е по-малко стабилна молекула и не модифицира ДНК на клетките, въпреки че предизвиква отговор вътре в клетката. Към днешна дата няма данни за това, колко дълго се произвежда вирусен протеин след приложението на РНК ваксини или за продължителността на индуцираната защита, което трябва да се изследва при участниците в проучването.
Друг интересен въпрос, присъщ на всяка ваксина за COVID-19, която се планира, е как ще се произвеждат, поддържат и разпространяват дозите ваксини, необходими за справяне с пандемията в голям мащаб.
Що се отнася до производството, както Pfizer / BioNTech, така и Moderna посочват, че очакват да произведат приблизително 20 милиона дози до края на 2020 г. Производствените данни за 2021 г. могат да достигнат 1 милиард дози в случая на Moderna и 1,3 милиарда в случай на Pfizer / BioNTech. Предвид необходимостта от две дози на човек, потенциално около 1 милиард души могат да бъдат ваксинирани от двамата производителя. Различни държави са сключили споразумения за получаване на ваксини.
Що се отнася до разпространението и съхранението, ваксината на Moderna предлага определени предимства пред тази на Pfizer, тъй като тя е стабилна при стайна температура в продължение на 12 часа, време достатъчно за планиране на ваксинация на различни места и може да се съхранява в хладилник (при 2-8ºC ) за 30 дни, което благоприятства съхранението и в здравни центрове. При широкомащабно изпращане и складиране ваксината е стабилна при температури от -20 ° C, свойствени за обикновения фризер, в продължение на 6 месеца. Ваксината Pfizer / BioNTech изисква температури от -70 ° C за съхранение, което може да представлява сериозен проблем за разпространението.
Извънредната ситуация, наложена от пандемията COVID-19, която вече е взела повече от един милион жертви по целия свят, ускори проектирането и производството на ваксините по такъв начин, че само за една година има няколко кандидати с голям потенциал. Ако резултатите от ваксините Pfizer / BioNTech и Moderna по отношение на безопасността и ефикасността се запазят, тяхното въздействие ще премине отвъд голямото постижение за спиране на пандемията. Одобрението на някоя от двете ваксини би представлявало първото одобрение на лекарство, основано на информационна РНК и би потвърдило очакванията за потенциала на информационната РНК като терапевтично средство, което различни изследователски екипи популяризират от години.
АКТУАЛИЗАЦИЯ 11-19-2020: Pfizer / BioNTech обяви на 18 ноември, че ваксината достига 95% ефективност въз основа на данни, получени от първите 170 участници в проучването, потвърдени като положителни за коронавируса на SARS-CoV-2. 162 от случаите са възникнали сред хора, получили плацебо. Останалите 8 са настъпили при хора, получили ваксината. Прессъобщението, с което се обявява, също така съобщава, че от 10 сериозни случая на COVID-19, девет са възникнали при хора, получили плацебо.
Публикувана на 17 ноември 2020 г.
Amparo Tolosa, Genotipia
Източник: https://genotipia.com/genetica_medica_news/vacunas-de-arn-covid-19/
Moderna’s COVID-19 Vaccine Candidate Meets its Primary Efficacy Endpoint in the First Interim Analysis of the Phase 3 COVE Study. https://investors.modernatx.com/news-releases/news-release-details/modernas-covid-19-vaccine-candidate-meets-its-primary-efficacy
Pfizer and BioNTech Announce Vaccine Candidate Against COVID-19 Achieved Success in First Interim Analysis from Phase 3 Study. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
A Phase 1/2/3 Study to Evaluate the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Individuals. https://www.pfizer.com/science/coronavirus
BioNTech and Pfizer Initiate Rolling Submission to European Medicines Agency for SARS-CoV-2 Vaccine Candidate BNT162b2. https://biontechse.gcs-web.com/news-releases/news-release-details/biontech-and-pfizer-initiate-rolling-submission-european
Pfizer and BioNTech Conclude Phase 3 Study of COVID-19 Vaccine Candidate, Meeting All Primary Efficacy Endpoints. https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine
Artículos científicos de ensayos de fase 1 o 2 de las vacunas:
Walsh EE, et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N Engl J Med. 2020 Oct 14:NEJMoa2027906. doi: 10.1056/NEJMoa2027906.
Anderson EJ, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020 Sep 29:NEJMoa2028436. doi: 10.1056/NEJMoa2028436.

Коментари
Публикуване на коментар